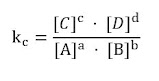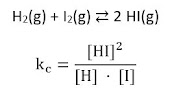LEY DE ACCIÓN DE MASAS
Para la reacción química reversible en equilibrio
aA + bB ⇄ cC + dD
se define la constante de equilibrio, kc, según la ley de acción de masas:
Siendo [A], [B], [C] y [D] las concentraciones en equilibrio de los reactivos A, B y los productos C y D.
Ejemplo de ley de acción de masas:
PROPIEDADES DE LA CONSTANTE DE EQUILIBRIO
1. El valor kc depende de los coeficientes estequiométricos usados para ajustar la reacción química, es decir, la misma reacción puede tener distintos valores de kc en función del ajuste realizado.
2. El valor de kc solo depende de la temperatura y no de las concentraciones iniciales.
3. Para calcular la constante de equilibrio solo se tienen en cuenta las especies gaseosas o en disolución. Se consideran constantes las concentraciones de las especies en estado sólido y líquido.
4. Las unidades de kc varían según sea la expresión matemática del equilibrio, aunque se suele considerar adimensional.
5. No proporciona información relativa a la velocidad a la que sucede la reacción.
SIGNIFICADO DE Kc
La constante kc indica indica en qué sentido avanza la reacción proporcionando información sobre si en el equilibrio se van a crear más reactivos (desplazamiento hacia la izquierda) o productos (desplazamiento hacia la derecha)
a) Si kc >> 1 el numerador es mayor que el denominador y por tanto la reacción se encuentra muy desplazada hacia la derecha (se forman más productos que reactivos). Si kc >>1000 se puede considerar que la reacción es irreversible.
b) Si kc ≈ 1 (0,1 < kc < 10), los reactivos y productos se encuentran en cantidades del mismo orden
en equilibrio.
c) Si kc << 1, casi no se forman productos y la reacción está desplazada hacia la izquierda.
Curso: Química 2º Bachillerato