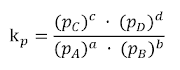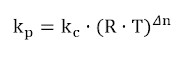Si los reactivos y productos de una reacción química se encuentran en estado gaseoso
aA(g) + bB(g) ⇄ cC(g) + dD(g)
se define la constante de equilibrio de las presiones, kp:
La relación entre kc y kp viene dada por la expresión:
siendo Δn la variación de moles (final menos inicial) de los gases que intervienen en la ecuación química.
→ En equilibrios heterogéneos (aparecen varios estado o fases) sólo se consideran los gases en las expresiones de kc y kp.
¿CUÁNDO USAR kc ó kp?
☑ En disoluciones diluidas usaremos kc.
☑ En reacciones gaseosas podremos utilizar tanto kp como kc.
Curso: Química 2º Bachillerato