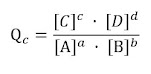Para la reacción química reversible que no se encuentra en equilibrio
aA + bB ⇄ cC + dD
se define el cociente de reacción, Qc, en un determinado instante:
Siendo:
- [A] y [B] las concentraciones de los reactivos A, B en un determinado instante.
- [C] y [D] las concentraciones de los productos C y D en un determinado instante.
Se pueden dar los siguientes casos:
a) Qc = kc: el sistema (la reacción) está en equilibrio.
b) Qc > kc: el sistema no está en equilibrio y la reacción evolucionará hacia la izquierda para aumentar la concentración de los reactivos (por tanto disminuye la de los productos) y hacer disminuir el valor de Qc.
aA + bB ← cC + dD
c) Qc < kc: el sistema no está en equilibrio y la reacción evolucionará hacia la derecha para aumentar la concentración de los productos (por tanto disminuye la de los reactivos) e incrementar el valor de Qc.
aA + bB → cC + dD
Curso: Química 2º Bachillerato