Como puedes imaginar, la masa de un átomo es muy pequeña y realizar cálculos es demasiado laborioso. Los químicos solucionaron esta dificultad definiendo un patrón a partir del cual calcular la masa de todos los átomos.
Este patrón se denomina unidad de masa atómica (u o uma), que se define como la doceava parte de la masa de un átomo de carbono 12:
1 uma = 1/12· masa de un átomo de 126C
Así, se definen:
- Molécula: unión de dos o más átomos iguales o diferentes.
Ejemplo: la molécula de CO2 está formado por 1 átomo de C y 2 átomos de O. - Masa atómica: es la masa del átomo expresada en uma y se localiza en la tabla periódica (número másico).
Ejemplo: m(K) = 39,10 u - Masa molecular: es la masa de una molécula y se calcula sumando la masa de cada uno de los átomos que la componen. Se suele redondear a 1 decimal.
Ejemplo: M(H2O) = 2·1 + 1·16 = 18 u
Otro de los problemas asociados al tamaño de los átomos es cómo contarlos, ya que cualquier cosa que podamos ver tiene más de 100.000.000.000.000.000.000.000 átomos o moléculas... La solución fue determinar una cantidad de partículas (átomos, moléculas,
iones...) que se denominó como Número de Avogadro (NA):
NA = 6,02·1023 partículas
Y aquí es donde surge el concepto de mol:
- Un mol es una cantidad de sustancia que contiene 6,02·1023 partículas
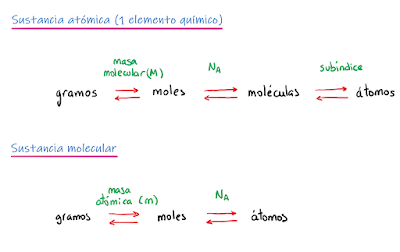
- La masa de un mol coincide con la masa atómica (si es un mol de átomos) o con la masa molecular (si es un mol de moléculas) expresado en gramos (en vez de uma).
Ejemplos de equivalencia entre moles, gramos y número de átomos:
- 6,02·1023 átomos de oro (Au) son 1 mol de oro;
- 1 mol de oro pesa 196,97 gramos;
- Por tanto, en 196,97 gramos de oro hay 6,02·1023 átomos de oro. ¡Acabamos de relacionar algo macroscópico (que podemos medir) con algo microscópico que no se puede ver!
- Además, si se trata de un gas ideal en condiciones normales, se cumple que 1 mol de gas siempre ocupa 22,4 L.