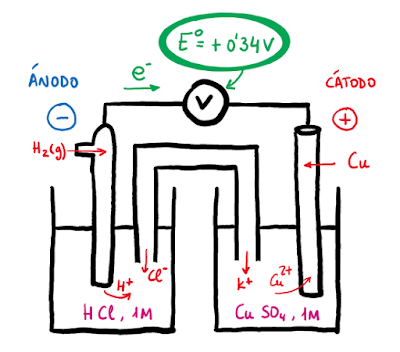
La
ddp entre los dos electrodos de una pila puede medirse directamente con
un voltímetro, aunque no se puede determinar el potencial de cada
electrodo individualmente (mismo caso que la energía potencial).
Por
convenio se asigna al potencia estándar del
electrodo de hidrógeno (1 bar
o 0,986923 atm; 25 ºC; 1M para todas las especies en disolución) el valor de cero voltios: Eº = 0,00 V. Este electrodo puede funcionar cómo ánodo o como cátodo, dependiendo de la naturaleza del otro electrodo.
- Si el otro electrodo es de cobre:
- Semirreacción de oxidación (ánodo -):
H2 (g, 1bar) → 2 H+(aq, 1M) + 2e- E° (H2/H+) = 0 V
- Semirreacción de reducción (cátodo +):
Cu2+ (aq) + 2e- → Cu (s) E° (Cu2+/Cu) = + 0,349 V (potencial estándar de reducción)
- Si el otro electrodo es de cinc:
- Semirreacción de oxidación (ánodo -):
Zn (s) → Zn2+ (aq) + 2e- E° (Zn/Zn2+) = 0,763 V (potencial estándar de oxidación)
* Para Zn2+ (aq) + 2e- → Zn (s) E° (Zn2+/Zn) = - 0,763 V (potencial estándar de reducción)
- Semirreacción de reducción (cátodo +):
2 H+(aq, 1M) + 2e- → H2 (g, 1bar) E° (H+/H2) = 0 V
De esta forma se pueden determinar experimentalmente los potenciales estándar de reducción en medio ácido:
| Serie de potenciales estándar de reducción |
| Agente oxidante |
Semirreacción de reducción |
E° (V) |
Agente reductor |
Muy fuerte
(poca tendencia a la reacción de oxidación) |
F2(g) + 2e- → 2F-(aq) |
+2,866 |
Muy débil
(gran tendencia a la reacción de reducción) |
| O3(g) + 2H+(aq) + 2e- → O2(g) + H2O(l) |
+2,075 |
|
S2O82-(aq) + 2e- → 2SO42-(aq) |
+2,01 |
|
| H2O2(aq) + 2H+(aq) + 2e- → 2H2O(l) |
+1,763 |
| MnO4-(aq) + 8H+(aq) + 5e- → Mn2+(aq) + 4H2O(l) |
+1,51 |
| PbO2(s) + 4H+(aq) + 2e- → Pb2+(aq) + 2H2O(l) |
+1,455 |
| Cl2(g) + 2e- → 2Cl-(aq) |
+1,358 |
| Cr2O72-(aq) + 14H+(aq) + 6e- → 2Cr3+(aq) + 7H2O(l) |
+1,33 |
| MnO2(s) + 4H+(aq) + 2e- → Mn2+(aq) + 2H2O (l) |
+1,23 |
| O2(g) + 4H+(aq) + 4e- → 2H2O(l) |
+1,229 |
| 2IO3-(aq) + 12 H+(aq) +10e- → I2(s) + 6H2O(l) |
+1,20 |
| Br2(l) + 2e- → 2Br-(aq) |
+1,065 |
| NO3-(aq) + 4H+(aq) + 3e- → NO(g) + 2H2O(l) |
+0,956 |
| Ag+(aq) + e- → Ag(s) |
+0,800 |
| Fe3+(aq) + e- → Fe2+(aq) |
+0,771 |
| O2(g) + 2H+(aq) + 2e- → H2O2(aq) |
+0,695 |
| I2(s) + 2e- → 2I-(aq) |
+0,535 |
| Cu2+(aq) + 2e- → Cu(s) |
+0,340 |
| SO42-(aq) + 4H+(aq) + 2e- → SO2(g) + 2H2O(l) *** |
+0,20 |
| S(s) + 2H+(aq) + 2e- → H2S(g) |
+0,14 |
|
2H+(aq) + 2e- → H2(g) |
+0,00 |
|
|
Pb2+(aq) + 2e- → Pb(s) |
-0,125 |
|
| Sn2+(aq) + 2e- → Sn(s) |
-0,137 |
| Fe2+(aq) + 2e- → Fe(s) |
-0,440 |
| Zn2+(aq) + 2e- → Zn(s) |
-0,763 |
| Al3+(aq) + 3e- → Al(s) |
-1,676 |
| Mg2+(aq) + 2e- → Mg(s) |
-2,356 |
| Na+(aq) + e- → Na(s) |
-2,713 |
| Ca2+(aq) + 2e- → Ca(s) |
-2,84 |
Muy débil
(gran tendencia a la reacción de oxidación) |
K+(aq) + e- → K(s) |
-2,924 |
Muy fuerte
(poca tendencia a la reacción de reducción) |
| Li+(aq) + e- → Li(s) |
-3,040 |
Curso: Química 2º Bachillerato
|