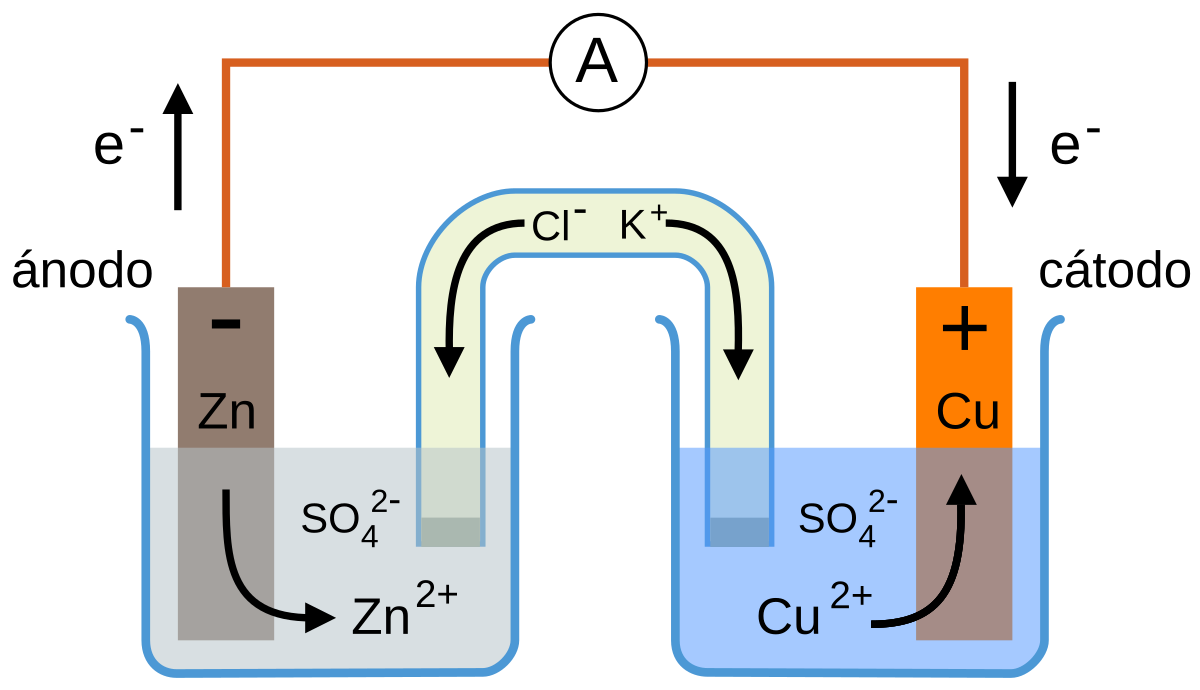
La
pila Daniell está formada por los siguientes elementos:
- Electrodo de Zn: es una lámina de zinc llamada ánodo en la que se produce la
semirreacción de oxidación: Zn(s) → Zn2+(aq) + 2e-
Según se va oxidando el ánodo reduce su masa, ya que el Zn2+(aq) pasa a la disolución.
- Electrodo de Cu: es una lámina de cobre llamada cátodo en la que se produce la
semirreacción de reducción: Cu2+(aq) + 2e- → Cu(s)
Aumenta su masa, ya que el Cu2+(aq) al reducirse se transforma en Cu sólido que se incorpora al electrodo.
- Una sal de Zn: habitualmente ZnSO4, en la que se sumerge el ánodo de Zn.
- Una sal de Cu: habitualmente CuSO4, en la que se sumerge el cátodo de Cu.
- Un conductor eléctrico externo que permite el paso de la corriente eléctrica desde el polo negativo (ánodo) al polo positivo (cátodo).
- Un sistema que separa las dos semirreacciones, que puede ser:
- Barrera porosa: se trata del diseño original y estaba formada por una vasija de barro que permitía el paso lento de los iones del electrolito (disolución) de modo que el sistema no se polarice (se explica con detalle en el puente salino).
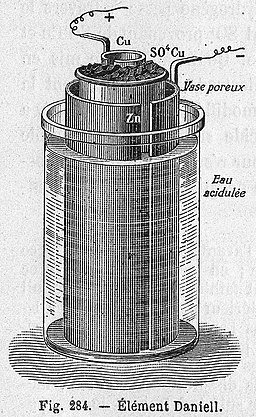 |
| Fuente: https://commons.wikimedia.org/wiki/File:%C3%89l%C3%A9ment_Daniell.jpg |
- Puente salino
El puente salino suele ser un tubo en forma de
∩ con una disolución acuosa de una sal (frecuentemente KCl saturado) con dos funciones:
- Evita la acumulación de carga en el electrolito:
- en el ánodo se acumula un exceso de cargas positivas Zn2+ que son neutralizadas por los iones Cl-.
- en el cátodo hay un defecto de cargas positivas que son compensadas por el movimiento de iones K+.
Notación de la pila electroquímica
La notación para una pila Daniell es:
Zn (s) | Zn2+ (aq, 1M) || Cu2+ (aq, 1M) | Cu (s)
| Zn (s) |
Zn2+ (aq, 1M) |
|| |
Cu2+ (aq, 1M) |
Cu (s) |
| Ánodo |
Disolución ánodo |
Puente salino |
Disolución cátodo |
Cátodo |
| Semirreacción de oxidación |
|
Semirreacción de reducción |
Curso:
Química 2º Bachillerato