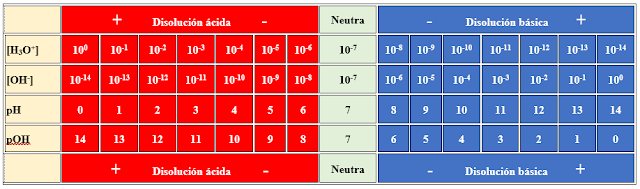
| La acidez o basicidad está relacionada con la concentración de de iones [H3O+] en una disolución. Este valor es muy pequeño y los cálculos farragosos, por lo que dicha concentración se expresa en escala logarítmica, llamada escala de pH (poder de hidrógeno - pouvoir hydorogene). Se define:
Kw = [OH-] . [H3O+]
log Kw = log [OH-] + log [H3O+] - log Kw = - log [OH-] - log [H3O+] 14 = pH + pOH Si una disolución tiene un valor de pH una unidad menor, es diez veces más ácida; si es dos unidades menor, la disolución será 100 veces más ácida.
Ejercicios ácido base resueltos
Ejercicio 1: Una disolución acuosa de NaOH a 25 °C tiene una concentración de iones hidróxido igual a 1,75 mol/L. Calcula la concentración de iones hidronio. Solución:
A 25 ºC, Kw = 1.10-14.
Kw = [OH-] . [H3O+]
1.10-14 = 1,75 · [H3O+]
[H3O+] = 5,71 · 10-15 mol/L
Ejercicio 2: Calcula la concentración de iones hidróxido que existen en 100 mL de agua pura que se encuentra a 60 °C, si Kw (60 ºC) = 9,6 · 10-14 . ¿Cuál será la concentración de iones hidronio? Solución:
En agua pura se cumple [OH-] = [H3O+]
9,6 · 10-14 = x · x
[OH-] = [H3O+] = 3,1 · 10-7
El dato V = 100 mL no se utiliza, ya que la concentración es independiente del volumen tomado; lo que sí cambia es el número de moles.
|