✔ El número de electrones que pueden encontrarse en un orbital atómico es igual al número de orbitales posibles (posibles ml) multiplicado por 2, ya que cada orbital puede alojar dos electrones, uno con espín +½ y otro con -½, y así cumplir el principio
de exclusión de Pauli.
Orbital s (l=0 y ml=0): puede alojar hasta 1·2 = 2 electrones.
Orbital p (l=1 y ml=-1, 0, +1): puede alojar hasta 3·2 = 6 electrones.
Orbital d (l=2 y ml=-2, -1, 0, +1, +2): puede alojar hasta 5·2 = 10 electrones.
Orbital f(l=3 y ml=-3, -2, -1, 0, +1, +2, +3): puede alojar hasta 7·2 = 14 electrones.
Los electrones comienzan a alojarse desapareados con el mismo espín y una vez semilleno el orbital se rellena con el espín opuesto, produciéndose el apareamiento.
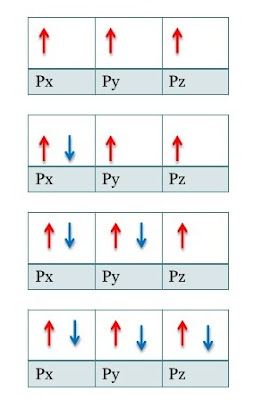 |
| Regla de Hund |
Curso: Química 2º Bachillerato