✔ Los electrones se distribuyen alrededor del núcleo en zonas donde es más probable encontrarlos (nunca tendemos la certeza de encontrarlos en una posición determinada).
✔ En cada nivel n pueden alojarse un máximo de 2·n2 electrones.
n=1 → 2 e-.
n=2 → 8 e-.
n=3 → 18 e-.
n=4 → 32 e-.
✔ La configuración electrónica nos proporciona la distribución de los electrones en sus orbitales (s, p, d, f).
✔ El orbital atómico es la región y espacio energético que se encuentra alrededor del átomo, y en el cual hay mayor probabilidad de encontrar un electrón.
✔ Existen 4 tipos de orbitales atómicos, en los que los electrones se van distribuyendo según la regla de máxima multiplicidad de Hund: Los electrones que entran en orbitales con igual energía (orbitales degenerados), lo hacen ocupando el mayor número posible (de orbitales) de forma que los electrones estén lo más desapareados posible.
- Orbital s (l=0 y ml=0): puede alojar hasta 1·2 = 2 electrones
- Orbital p (l=1 y ml=-1, 0, +1): puede alojar hasta 3·2 = 6 electrones
- Orbital d (l=2 y ml=-2, -1, 0, +1, +2): puede alojar hasta 5·2 = 10 electrones
- Orbital f (l=3 y ml=-3, -2, -1, 0, +1, +2, +3): puede alojar hasta 7·2 = 14 electrones
✔ Los electrones van colocándose desde los niveles y subniveles de energía más bajos a los más altos.
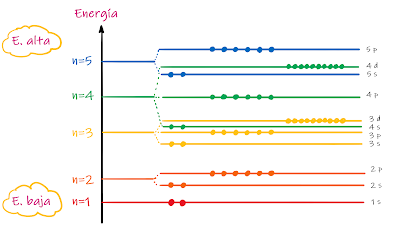 |
| Niveles de energía atómicos |
✔ El diagrama de Moeller permite obtener la configuración electrónica por niveles (n) y subniveles (s, p, d, f) de energía, de menor a mayor (proceso similar al llenado de agua de una botella, que se deposita primero en la parte más baja).
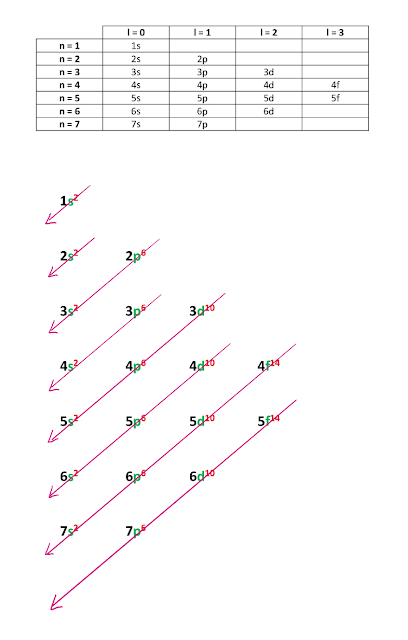 |
| Diagrama de Moeller |
Curso: Química 2º Bachillerato