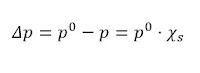| Como
ya sabes, al dejar un líquido suficiente tiempo en contacto con la
atmósfera termina evaporándose. Algunas partículas situadas en la
superficie del líquido tienden a cambiar de estado pasando a vapor debido a su velocidad (no confundir con ebullición).
Sin
embargo, al cerrar una botella con agua aparecen pequeñas gotas en su
superficie. Algunas moléculas de la superficie del líquido han sido
capaces de pasar a vapor y algunas de estas pasan de nuevo a líquido,
lográndose un equilibrio entre la velocidad de vaporización y condensación.
La presión de vapor de un líquido se define como como la presión que realizan las moléculas de vapor en equilibrio con el líquido. Cuanta mayor es la temperatura mayor es también la presión de vapor. Por tanto, las sustancias con mayor presión de vapor se evaporarán antes en contacto con la atmósfera. Ley de Raoult: al disolver un soluto en un disolvente puro la movilidad disminuye, pasando menos partículas al estado vapor. Se produce una disminución de la presión de vapor que viene dada por la siguiente fórmula que relaciona la variación de presión del disolvente puro y la disolución en función de la fracción molar del soluto presente.
+ información: https://www.youtube.com/watch?v=c62ChQmbg6A
|