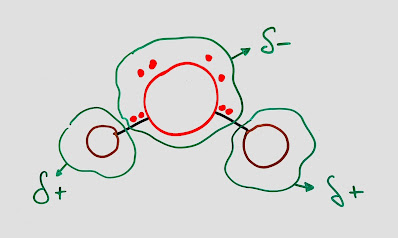
Las fuerzas intermoleculares son de naturaleza física, y permiten mantener unidas las moléculas de líquidos y sólidos. Si no existieran todas las sustancias moleculares serían gases.
Los enlaces entre los átomos de una molécula son de naturaleza química (compartición o intercambio de electrones). La energía de enlace entre dos átomos coincide con la energía de disociación de la correspondiente molécula diatómica.
Las fuerzas intermoleculares son débiles (comparadas con la energía de disociación necesaria para separar los átomos en un enlace química) y atractivas.
Los enlaces entre los átomos de una molécula son de naturaleza química (compartición o intercambio de electrones). La energía de enlace entre dos átomos coincide con la energía de disociación de la correspondiente molécula diatómica.
Las fuerzas intermoleculares son débiles (comparadas con la energía de disociación necesaria para separar los átomos en un enlace química) y atractivas.
- Así, la energía de ruptura de la molécula Cl-Cl es E(Cl-Cl) = 242 kJ/mol; mientras que la energía requerida para separar dos moléculas de Cl (aportando calor hasta llegar a la ebullición) es ΔHvaporización = 21 kJ/mol.
- En el caso del agua la energía de ruptura de la molécula H2O en H + O + H es 2.E(O-H) = 930 kJ/mol; mientras que la energía requerida para separar dos moléculas de agua (aportando calor hasta llegar a la ebullición) es ΔHvaporización = 41 kJ/mol.
DIPOLOS
- Dipolo permanante: se forman en las moléculas polares debido al desplazamiento de carga permanente.
- Dipolo instantáneo: se produce cuando en una molécula apolar los electrones se concentran en una región concreta en un momento determinado.
- Dipolo inducido: las moléculas vecinas al dipolo instantáneo crean un dipolo inducido por inducción.
a) Fuerzas de dispersión o de London (o dipolo instantáneo-dipolo inducido):
He (4,2 K) < Ne (27,1 K) < Ar (87,3 K) < Kr (119,9 K) < Xe (165 K) < Rn (211,5 K)
|
b) Fuerzas dipolo permanente-dipolo inducido:
|
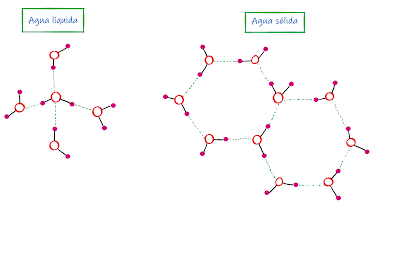
d) Enlace de hidrógeno:
|